研究内容
ArfGAPファミリーは低分子量GTP結合タンパク質ArfのGTP結合型を加水分解する酵素群のことです。ArfはGTP結合型でオルガネラ膜に結合し、さらにコートタンパク質にも結合して輸送小胞の形成を促します。ArfGAPはArf-GTPをArf-GDPに変換するため、Arfを不活性化し、脱コートを促して、小胞輸送には阻害的に機能すると考えられてきました。
しかしながら、ArfGAPは選別に機能するというデータがさまざまな研究により明らかになってきました。芝はこれまで輸送を阻害すると考えられていたArfGAPがポストゴルジにおいては輸送に促進的に機能することを突き止めました(Shiba Y. et al. J Cell Sci 123(14):2381-90, 2010)。さらにゴルジ体から出芽するCOPI小胞についても、積荷がCOPIに結合したときにArfGAP1のGAP活性が上がり、COPIの多量体化を促進することを明らかにし、これらを元にArfGAP1がCOPIと積荷の結合時に積荷の選別を行っているという新規のCOPI小胞形成のモデルを提案しました(図1、Shiba Y. et al Cell Logist (4):139-154, 2011、Shiba Y and Randazzo PA, Histol Histopath Sep;27(9):1143-53, 2012)。このモデルはポストゴルジの輸送にも適用でき、そのモデルを元にがん化に重要な上皮成長因子受容体(EGFR)を分解経路に選別して輸送する新規のArfGAPを同定しました(Shiba Y, Curr Biol, Oct7;23(19):1945-1951, 2013)。
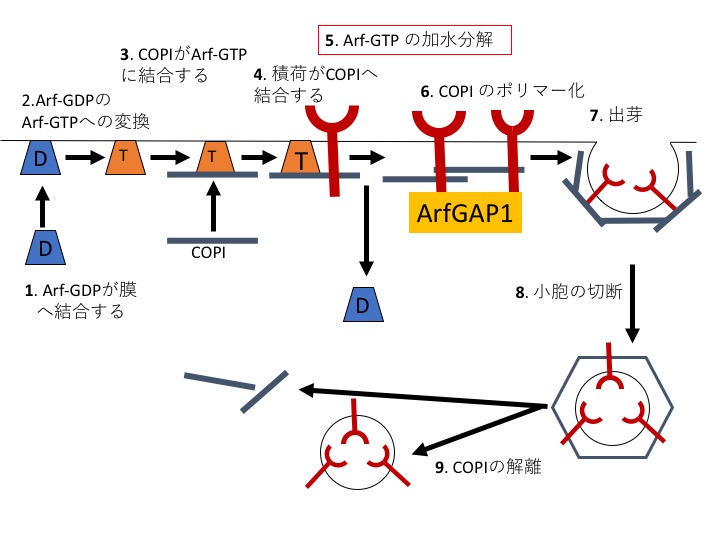
図1;ゴルジ体から出芽するCOPI小胞の新規モデル。
図2;ゴルジ体から出芽する輸送小胞
ヒトではArfGAPドメインを持つタンパク質は31遺伝子あり、数が多いのですが、外来の異物が細胞内に入ってきたときに、どの積荷が危険でどの積荷が危険でないのか、それを選別するために数が増えていったのではないかと考えています。
現在は止血因子vWF, 細胞外小胞マーカーCD63、ナノサイズの金属である磁性ナノ粒子、を積荷として用い、輸送機構を研究しています。どの積荷も従来の積荷受容体の細胞質領域がコートタンパク質に認識されて輸送されるというモデルとは異なると考えていますが、vWFとCD63でも新規のArfGAPが同定されて来ました。どのようにArfGAPがvWFやCD63を選別しているのか、その解明により新規の選別機構モデルが提案できます。
また磁性ナノ粒子を用いた研究では、磁性ナノ粒子はどのくらいの物理的な力でオルガネラ膜を損傷できるのか、その膜損傷や膜の物性をArfGAPが認識できるのか、それは積荷の選別に繋がるのか、これらの視点で研究を進めています。
1) vWFの輸送機構の解明
von Willebrand Factor (vWF)は止血因子で、血管内皮細胞の小胞体で合成され、ゴルジ体を経てWeibel-Palade Body (WPB)と呼ばれる葉巻型の分泌顆粒に輸送されます。外部刺激によりWPBは細胞膜と融合し、vWFは血中へ放出され、血小板と結合して血液凝固に関与します(図3)。ヒト臍帯静脈血管内皮細胞(HUVEC)およびHEK293細胞で、ArfGAPのsiRNAを用いて葉巻型WPBの形状変化を指標にArfGAPを探索したところ、SMAP1とAGFG2を新規に同定しました。SMAP1欠損細胞では葉巻型WPBが顆粒状となり、その後の解析から、葉巻型WPBの形成ではなく、分解もしくは分泌にSMAP1が関与しているのではないかと考え研究を進めています。AGFG2欠損細胞ではヒスタミンなどの刺激依存性のvWFの分泌が阻害されたことから、WPBが細胞膜と融合する過程に関与すると考えています(Watanabe et al. Biology Open, 2021)。vWFを認識してWPBへ輸送する受容体は見つかっていないため、SMAP1やAGFG2がどのようにvWFやWPBを認識するのか、特にSMAP1がどのようにWPBのサイズを認識するのか、興味のあるところです。
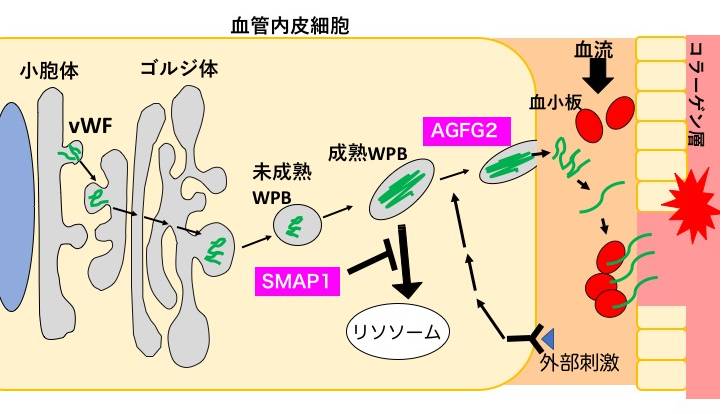
図3;vWFは血管内皮細胞の小胞体で合成され、ゴルジ体を経て WPBと呼ばれる分泌顆粒へ詰め込まれる。
その後外部刺激をへて血中へ放出される。SMAP1はWPBの分解に、AGFG2はvWFの分泌に関与すると考えられる。
2) エクソソームの形成機構の解明
細胞外小胞(Extracellular Vesicles, EVs)は、がん細胞などから放出されると、転移先の組織の細胞に取り込まれてがんが増殖しやすくなることが知られています。EVsはがんのバイオマーカーや、薬剤を積み込むことによってDDSなどにも応用できるのでは無いかと考えられています。しかしながら、EVは極めて多様で、異なるEVが混ざっており、どのように区別するのか、どのように機能が違うのか、不明な点が多いです。
エクソソームはEVの一つで、エンドソーム由来のものです(図4)。細胞膜由来のEVsはMicro vesicle(MV)と呼ばれていますが、血液や組織液などでは様々な細胞から分泌されたEVsが全部混ざっています。エクソソームはエンドソームでMVとは異なる積荷をパッケージングし、機能も異なると考えられます。
当研究室ではエンドソームに着目し、エクソソームの形成に関与するArfGAPを新規に発見しました (Kasumi Suzuki, Yoshitaka Okawa, Sharmin Akter, Haruki Ito and Yoko Shiba, bioRxiv, 2024)。ArfGAPを用いれば異なるEVsが区別できるかもしれません。現在より詳細な機能を解析中です。
図4;エクソソームはエンドソーム由来の細胞外小胞で、エンドソームで細胞質を取り込んだILVが放出されたものと考えられている。
3)磁性ナノ粒子
磁性ナノ粒子は磁気を帯びたナノサイズの粒子のことです。マグネタイトは20nmといった小さなサイズでは、磁場を印加しなければ磁気を持たない超常磁性になると考えられます。磁性ナノ粒子を細胞内に取り込み後、外から磁場を印加することによってオルガネラ内で磁性ナノ粒子を運動させることができると考えています。当研究室では磁性ナノ粒子を利用して、オルガネラの内側からの膜損傷の解明に取り組んでいます。磁性ナノ粒子は薬剤をつけたり、ナノ粒子をがん細胞に取り込ませた後、外から磁場をかけることによってナノ粒子を振動させ、熱を生み出してがん細胞を殺すなどの医学応用が考えられてきました。本研究によって細胞を殺すだけではなく、精密なオルガネラのコントロールによって細胞を操作することができるようになるかもしれません。本研究はマテリアルコースの小林・大柳グループ、化学コースの芝崎グループとの共同研究によって行っています。異分野融合型研究であることから、岩手大学理工学部のSPERCの支援を受けました。
磁性ナノ粒子の修飾について芝崎研究室との共同研究で報告しました(Ayane Kawamura et al, Polymer 294 (2024) 126724)。現在は膜損傷について研究を進めています。
図5;磁性ナノ粒子の取り込み
4)発表論文
- Kasumi Suzuki, Yoshitaka Okawa, Sharmin Akter, Haruki Ito and Yoko Shiba, Arf GTPase-Activating proteins ADAP1 and ARAP1 regulate incorporation of CD63 in multivesicular bodies, bioRxiv, February 16, 2024
- Ayane Kawamura, Mirai Saijyo, Boldbaatar Bayarkhuu, Naoki Nishidate, Ibuki Oikawa, Satoru Kobayashi, Koichi Oyanagi, Yoko Shiba, Tadashi Tsukamoto, Yoshiyuki Oishi, Yuji Shibasaki, Fabrication of hyperbranched-polyglycidol-Fe3O4 nanocomposite labeled with fluorescein isothiocyanate via rapid ligand exchange reaction, Polymer, 294,126724, 2024
- Watanabe A, Hataida H, Inoue N, Kamon K, Baba K, Sasaki K, Kimura R, Sasaki H, Eura Y, Wei-Fen Ni, Shibasaki Y, Waguri S, Kokame K and Shiba Y, Arf GTPase-Activating proteins SMAP1 and AGFG2 regulate the size of Weibel-Palade bodies and exocytosis of von Willebrand factor, Biology Open, Sep 15, 10, bio058789, 2021, <優秀ポスター賞>第43回日本血栓止血学会, 5/28-5/31, 2021
- Kajiwara R, Seto A, Kofujita H, Shiba Y, Oishi Y and Shibasaki Y, Enhanced antimicrobial activities of polymerized arbutin and its derivatives prepared by oxidative polymerization of arbutin Reactive and Functional Polymers, 138, 39?45, 2019
- Saito M and Shiba Y, ER stress, secretory granule biogenesis and insulin, Ultimate Guide to Insulin, Chapter 3, 37-56, InTechOpen, Nov.5, 2018
- Sato H, Shiba Y*, Tsuchiya Y, Saito M, Kohno K*. 4μ8C inhibits insulin secretion independent of IRE1α RNase activity. * Corresponding Author, Cell Struct Funct. May 3;42(1):61-70, 2017
- Shiba Y, ArfGAPs; Depletion or overexpression? Res Rev Insights, 1,1, 2017
- Shiba Y, Randazzo PA. ArfGAPs: key regulators for receptor sorting. Receptors Clin Investig. Jun 13;1(5):e158. 2014
- Greer YE, Westlake CJ, Gao B, Bharti K, Shiba Y, Xavier CP, Pazour GJ, Yang Y, Rubin JS. Casein Kinase 1 Delta Functions at the Centrosome and Golgi to Promote Ciliogenesis. Mol Biol Cell. May 15;25(10):1629-40, 2014
- Shiba Y, Kametaka S, Waguri S, Presley JF, Randazzo PA. ArfGAP3 Regulates the Transport of Cation-Independent Mannose 6-Phosphate Receptor in the Post-Golgi Compartment. Curr Biol. Oct 7;23(19):1945-1951, 2013,
NIH, USA 2014 - Luo R, Akpan IO, Hayashi R, Sramko M, Barr V, Shiba Y, Randazzo PA. GTP-binding protein-like domain of AGAP1 is protein binding site that allosterically regulates ArfGAP protein catalytic activity. J Biol Chem. May 18;287(21):17176-85, 2012
- Shiba Y. and Randazzo PA. ArfGAP1 function in COPI mediated membrane traffic: Currently debated models and comparison to other coat-binding ArfGAPs, Histology and Histopathology, Sep;27(9):1143-53, 2012
- Shiba Y, Luo R, Hinshaw JE, Szu T, Hayashi R, Sztu E, Nagashima K, Baxa U and Randazzo RA. ArfGAP1 promotes COPI vesicle formation by facilitating coatomer polymerization. Cellular Logistics, (4):139-154, 2011 <口頭発表>ArfGAP1 contributes to the formation of transport intermediates. Arf family G proteins, FASEB summer meeting, Pheonix, Arizona, USA, 2010
- Shiba Y. and Randazzo P. GEFH1 binds to ASAP1 and regulates Podosome formation. Biochem Biophys Res Commun. 406(4):574-9, 2011
- Spang A, Shiba Y, Randazzo PA. Arf GAPs: gatekeepers of vesicle generation. FEBS Lett. Jun 18;584(12):2646-51, 2010
- Shiba Y, Romer W, Mardones G, Burgos P, Lamaze C, and Johannes L. AGAP2 regulates retrograde transport between early endosomes and the TGN. J Cell Sci 123(14):2381-90, 2010
- Yogosawa S, Kawasaki M, Wakatsuki S, Kominami E, Shiba Y, Nakayama K., Kohsaka S, and Akazawa C. Monoubiquitylation of GGA3 by hVPS18 regulates its ubiquitin-binding ability. Biochem Biophys Res Commun. 350(1):82-90, 2006
- Kawasaki M, Shiba T, Shiba Y, Yamaguchi Y, Matsugaki N, Igarashi N, Suzuki M. Kato R, Kato K., Nakayama K., and Wakatsuki S. Molecular mechanism of ubiquitin recognition by GGA3 GAT domain. Genes Cells. 10(7):636-54, 2005
- Katoh Y, Shiba Y, Mitsuhashi H, Yanagida Y, Takatsu H, and Nakayama K, Tollip and Tom1 form a complex and recruit ubiquitin-conjugated proteins onto early endosomes. J Biol Chem. 279(23):24435-43, 2004
- Shiba Y, Katoh Y, Shiba T, Yoshino K, Takatsu H, Kobayashi H, Shin HW, Wakatsuki S, and Nakayama K. GAT(GGA and Tom1) domain responsible for ubiquitin binding and ubiquitination. J Biol Chem 279(8):7105-11, 2004
- Wakasugi M. Waguri S, Kametaka S, Tomiyama Y, Kanamori S, Shiba Y, Nakayama K, and Uchiyama Y. Predominant expression of the short form of GGA3 in human cell lines and tissues. Biochem Biophys Res Commun 306(3):687-92, 2003
- Nogi T, Shiba Y, Kawasaki M, Shiba T, Matsugaki N, Igarashi N, Suzuki M, Kato R, Takatsu H, Nakayama K and Wakatsuki S, Structural basis for the accessory protein recruitment by the gamma-adaptin ear domain. Nat Struct Biol. 9(7):527-31, 2002
- Shiba Y, Takatsu H, Shin HW and Nakayama K. Gamma-adaptin interacts directly with Rabaptin-5 through its ear domain. J Biochem. 131(3):327-36, 2002
- Takatsu H, Katoh Y, Shiba Y, and Nakayama K. Golgi-localizing, gamma-adaptin ear homology dmain, ADP-rybosylation factor-binding (GGA) proteins interact with acidic dileucine sequences within the cytoplasmic domains of sorting receptors through their Vps27p/Hrs/STAM(VHS) domains. J Biol Chem. 276(30):28541-5, 2001
